Shpёrndarja e elektroneve nё atom
Shpёrndarja e elektroneveve nёpёr orbitale atomike me energji tё ndryshme bёhet duke u bazuar nё disa rregulla e parime:
a) Parimi i Aufbaut
b) Parimi i pёrjashtimit tё Paulit
c) Rregulla e Hundit
a. Sipas parimit tё Aufbaut (ose parimit tё qёndrueshmёrisё) mbushja me elektrone e niveleve, nёnniveleve dhe gjendjeve energjitike, fillon nga niveli me energji mё tё ulёt deri tek niveli me energji mё tё lartё. Mbushja bёhet shkallё-shkallё sipas rregullit tё rritjes sё energjisё.
Rregulli 1
Shkalla e rritjes sё energjisё sё niveleve ёshtё ajo e rritjes sё vlerёs sё numrit kuantik themelor, ku niveli i parё n = 1 i cili ёshtё mё afёr bёrthamёs ka energji mё tё ulёt, ndёrsa niveli n =7 ka energji mё tё lartё.
Rregulli 2
Shkalla e rritjes sё enegjisё sё nёnniveleve, brenda nivelit pёrkatёs ёshtё sipas rradhёs s, p, d, f (nёnniveli s ka energji mё tё ulёt se nёnniveli p, nёnniveli p ka energji mё tё ulёt se nёnniveli d, dhe nёnniveli d ka energji mё tё ulёt se nёniveli f)
Rradha e mbushjes me elektrone tё niveleve, nёnniveleve dhe gjendjeve energjitike sipas energjisё nё rritje jepet nёpёrmjet skemёs sё mёposhtme:

Mund tju rikujtojmё:
a) Nёnniveli s ka njё gjendje energjitike dhe mban 1-2e-
b) Nёnniveli p ka 3 gjendje energjitike dhe mban 1-6e-
c) Nёnniveli d ka 5 gjendje energjitike dhe mban 1-10e-
d) Nёnniveli f ka 7 gjendje energjitike dhe mban 1-14e-
Kёto elektrone vendosen nё pёrputhje me parimin e pёrjashtimit tё Paulit i cili thotё:
Nё
njё
gjendje energjitike nuk mund tё
vendosen mё shumё
se dy elektrone. Ata duhet tё
jenё
me spine tё kundёrta.
![]()
Gjendje tё
tilla si a) ![]() ose
b)
ose
b) ![]() ku
elektronet janё me spine paralele nuk
janё
tё
qёndrueshme
pasi shuma e vlerave tё
numrave kuntikё spinё
ёshtё:
ku
elektronet janё me spine paralele nuk
janё
tё
qёndrueshme
pasi shuma e vlerave tё
numrave kuntikё spinё
ёshtё:
a) ![]() ose
b)
ose
b) ![]()
Pёr nёnnivelet tё cilat kanё mё shumё se njё gjendje energjitike (p, d, f) mbushja me elektrone bёhet nё pёrputhje me rregullёn e Hundit. Nё fillim mbushen me nga njё elektron tё gjithё gjendjet energjitike qё ndodhen nё njё nёnnivel ,mё pas fillohet pёrsёri nga e para me çiftёzimin e elektroneve tё vendosura mё parё, nё mёnyrё qё shuma e spineve tё jetё maksimale. Pёr shembull nёnniveli p ka 3 gjendje energjitike dhe mban 6e- . si fillim mbushen tё tria gjendjet me nga njё elektron dhe me elektronet qё mbeten, fillon çiftёzimi nga kutia e parё deri tek e treta, duke kaluar nga e majta nё tё djathtё.
Hapi I
![]()
Hapi II
![]()
Hapi III
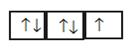
Hapi IV
![]()
Formula elektronike dhe konfigurimi elektronik i atomit tё njё elementi
Mёnyra e shpёrndarjes sё elektroneve nё atom paraqitet me anё tё
a) formulёs elektronike
b) konfigurimit elektronik
Formula elektronike na tregon rradhёn e mbushjes me elektroneve tё niveleve dhe nёnniveleve. Konfigurimi elektronik na tregon mbushjen me elektrone tё niveleve, nёnniveleve dhe gjendjeve energjitike
Le tё shohim njё shembull pёr shpёrndarjen e elektroneve nё atomin e elementit azot.
Atomi i azotit N ka Z= 7, ai ka 7 elektrone nё mbёshtjelljen elektronike. Shpёrndarja e 7 elektroneve bёhet sipas diagramit tё Aufbaut.
Hapi parё:
Nё fillim mbushet nёnniveli i parё 1s me 2 elektrone 1s2
Hapi i dytё:
Mё pas 5 elektronet qё mbeten do tё shpёrndahen nё nivelin e dytё . Nё nivelin e dytё ndodhen dy nёnnivele s dhe p.
Nё fillim mbushet nёnniveli 2s me dy elektrone dhe 3 elektronet e tjera qё mbeten vendosen nё nёnnivelin 2p. d.m.th 2s2p3
Formula elektronike ёshtё 1s2 2s2 p3
Duke u bazuar nё formulёn elektronike 1s22s2 p3 paraqesim konfigurimin elektronik, ku çdo nёnnivel e paraqesim me anё tё gjendjeve energjitike tё tij. Vendosim nё çdo gjendje elektronet, duke u bazuar nё parimin e Paulit dhe nё rregullёn e Hundit. Konfigurimi elektronik pёr atomin e azotit:
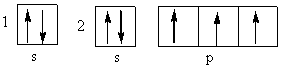
Mё poshtё nё kёtё faqe ёshtё inkluduar applet-i i cili demonstron shpёrndarjen e elektroneve nё atomet e tabelёs sё elementeve
Duke klikuar nё tabelёn periodike njё element, applet-i shfaq tё dhёna e kёtij elementi, si grupi ku bёn pjesё, emri, simboli, numri atomik (Z) si dhe masa atomike.
Shembull 1
Duke klikuar magnezin jepen kёto tё dhёna:
Metalet alkalino-tokёsor grupi II A
Emri elementit: Magnez
Simboli: Mg
Numri atomik(Z) : 12
Masa atomike : 24
Nё tё djathtё tё tabelёs jepet shpёrndarja e elektroneve sipas diagramit tё Aufbaut:
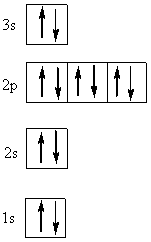
Nё bazё tё konfigurimit shkruani formulёn elektronike.
Formula elektronike ёshtё : 1s2 2s2 2p6 3s2
Shembulli 2
Pёr shembull duke klikuar manganin jepen kёto tё dhёna:
Metale kalimtare VII B
Emri elementit: Mangan
Simboli: Mn
Numri atomik(Z) : 25
Masa atomike : 54,94
Nё tё djathtё tё tabelёs jepet shpёrndarja e elektroneve sipas diagramit tё Aufbaut:
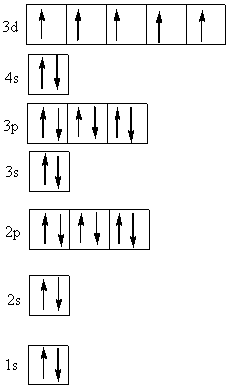
Nё bazё tё konfigurimit shkruani formulёn elektronike.
Formula elektronike ёshtё : 1s2 2s2 2p6 3s2 3p6 4s2 3d5
Vazhdoni nё kёtё mёnyrё pёr elementёt e tjerё.